The Correlation of P53 and MSI Immune Markers in Gastric Adenocarcinoma
DOI:
https://doi.org/10.32007/jfacmedbagdad.6622290الكلمات المفتاحية:
سرطان المعدة، الكيمياء النسيجية المناعية، التصنيف الجزيئي، P53، عدم استقرار الساتل الميكرويالملخص
العلاقة بين تعبير المعلمات المناعية ل (P53) وعدم استقرار الساتل الميكروي (MSI) مع العوامل السريرية المرضية لسرطان المعدة الغدي باستخدام الكيمياء النسيجية المناعية.
الخلاصة
الخلفية: يحدث سرطان المعدة الغدي بسبب عدم استقرار الكروموسومات، وطفرات TP53، واختلال الصيغة الصبغية، والانتقالات، والجينات الورمية الأولية، والتغيرات الجينية المثبطة للورم.عدم استقرار الساتل الميكروي(MSI) يسبب فشل إصلاح عدم تطابق الحمض النووي، مما يؤثر على دقة تكرار الحمض النووي. يم الكشف عن أخطاء النسخ المتماثل المبكرة بواسطة مجمع البروتين المتغاير (hMSH2/hMSH6) ، الذي يقوم بتفعيل hMLH1) و(hPMS2 لإعادة تكوين الحمض النووي. يحدث عدم استقرار الساتل الميكروي في حالات سرطان المعدة المتفرق ومتلازمة لينش.
الهدف من الدراسة: دراسة العلاقة بين تعبيرالمعلم P53 وتعبير المعلمات المناعية لـعدم استقرار الساتل الميكروي (MSI) مع العوامل السريرية المرضية لسرطان المعدة الغدي باستخدام الكيمياء النسيجية المناعية.
المواد والطرق: تم فحص 40 كتلة من نسيج سرطان المعدة الغدي المثبت بالفورمالين والمطمور بالشمع في بغداد، العراق. تناولت الدراسة حالات سرطان المعدة الأولية، مع البيانات السريرية المرضية المتاحة، والأنسجة الجراحية. التعبير المناعي الكيميائي الذي تم تقييمه بواسطة نظام تسجيل النقاط. تم استخدام برنامج SPSS لتحليل البيانات، كما تم استخدام اختبارات Chi-square واختبارات Fisher الدقيقة لتقييم الارتباطات. تم اعتبار مستوى الثقة 95٪ والقيمة الاحتمالية P 0.05 أو أقل مهمًا.
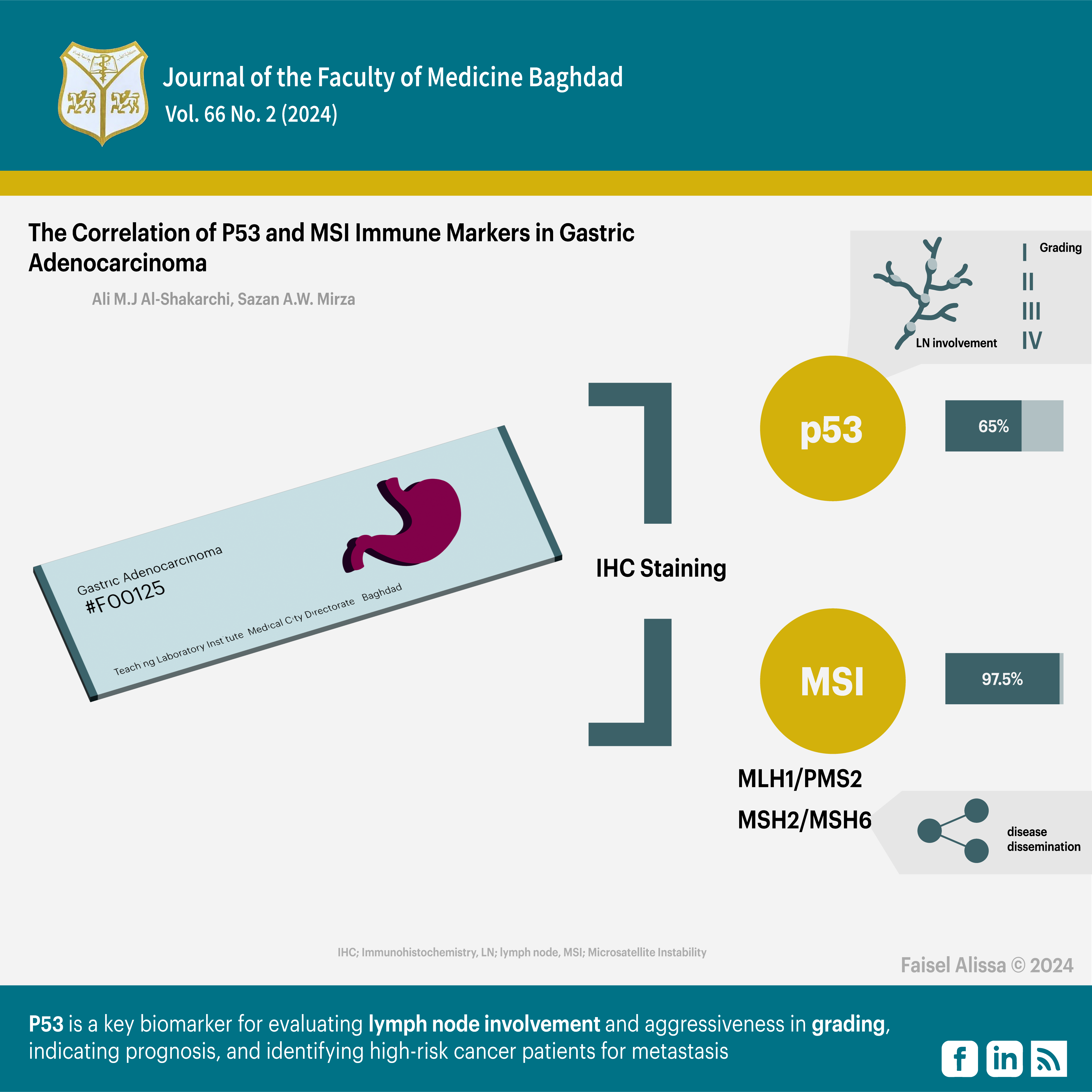
النتائج : كان التصبيغ المناعي النسيجي الكيميائي لـ P53 إيجابيًا في 65٪ من الحالات، بينما كانت نتائج MSI إيجابية في 97.5٪ من الحالات. حصل الزوجان المتغايران MLH1/PMS2 على نتائج إيجابية بنسبة 32.5% ونتائج سلبية 67.5%، في حين حصل الزوجان المتغايران MSH2/MSH6 على نتائج إيجابية بنسبة 87.5% ونتائج سلبية 12.5%. ارتبطت صبغة P53 بشكل كبير بانتشار العقدة الليمفاوية ودرجة الورم ، ولكن لم يكن هنالك ارتباط مع العوامل الأخرى. لم يتم العثور على ارتباط كبير بين معلمات MSI والعوامل المدروسة,لم يكن هناك ارتباط كبير بين معلمات MSI غير المتجانسة (MLH1 / PMS2) والمعلمات المرضية السريرية، ولكن كان هناك ارتباط كبير بين علامات MSI الزوجين غير المتجانسة (MSH2 / MSH6) والنقائل فقط .
الاستنتاج: : يعد P53 معلما حيويا مهما لتقييم انتشار العقدة الليمفاوية وعدوانيتها في التصنيف النسيجي، مما يشير إلى التشخيص، وتحديد مرضى السرطان الأكثر عرضة لخطر الإصابة بالورم النقيلي. على الرغم من أن MSH2/MSH6 اظهر ارتباطا مهمًا مع النقائل الورمية ، إلا أن معلمات MSI كان لها أقل قيمة إنذارية في دراستنا. هناك حاجة إلى مزيد من البحث لإثبات فعاليتها في علاج سرطان المعدة.
التنزيلات
المراجع
1. Ilic M, Ilic I. Epidemiology of stomach cancer. World journal of gastroenterology. 2022;28(12):1187. https://doi.org/10.3748/wjg.v28.i12.1187
2. Ferlay J, Colombet M, Soerjomataram I, Parkin DM, Piñeros M, Znaor A, et al. Cancer statistics for the year 2020: An overview. International journal of cancer. 2021;149(4):778-89. https://doi.org/10.1002/ijc.33588
3. Mwafaq RK, Abbas AK, Abdullah LAH. Evaluation of PARP-1 by imm unohistochemistry in a sample of Iraqi patients with gastric cancer. Iraqi Journal of Science. 2022:467-79. https://doi.org/10.24996/ijs.2022.63.2.5
4. Ashour HJ, Al-Bakri NA, Abdul Ghafour KH. The Immunohistochemical Assessment of Muc5ac in Patients with Gastric Carcinoma (Gc) in Iraq. Iraqi Journal of Science. 2019:460-8. https://www.ijs.uobaghdad.edu.iq/index.php/eijs/article/view/683
bservatory gc. global cancer observatory 2023 [Available from: https://gco.iarc.fr/today].
6. Toh JW, Wilson RB. Pathways of gastric carcinogenesis, Helicobacter pylori virulence and interactions with antioxidant systems, vitamin C and phytochemicals. International journal of molecular sciences. 2020 Sep 3;21(17):6451. https://doi.org/10.3390/ijms21176451
7. Torbenson M, Ng I, Park Y, Roncalli M, Sakamato M. WHO Classification of Tumours. Digestive System Tumours. Lyon, France: International Agency for Research on Cancer. 2019:229-39. https://dokumen.pub/who-classification-of-tumours-5th-edition-digestive-system-tumours-1-5nbsped-9789283244998.html
8. Lauwers G, Kumarasinghe P, Cytopath D. Gastric cancer: Pathology and molecular pathogenesis. UpToDate, UptoDate, Waltham, MA. 2020. https://www.medilib.ir/uptodate/show/119517
9. Nishizawa T, Nakano K, Harada A, Kakiuchi M, Funahashi S-I, Suzuki M, et al. DGC-specific RHOA mutations maintained cancer cell survival and promoted cell migration via ROCK inactivation. Oncotarget. 2018;9(33):23198. https://doi.org/10.18632/oncotarget.25269
10. Nakayama I, Shinozaki E, Sakata S, Yamamoto N, Fujisaki J, Muramatsu Y, et al. Enrichment of CLDN18‐ARHGAP fusion gene in gastric cancers in young adults. Cancer Science. 2019;110(4):1352-63. https://doi.org/10.1111/cas.13967
11. Al-Badri BA, Ali GQ. P53 Expression in Gastric Dysplasia and carcinoma in Erbil city. Journal of the Faculty of Medicine Baghdad. 2011;53(2):190-3. https://doi.org/10.32007/jfacmedbagdad.532869
12. Habib M. The possible role of EBV in carcinogenesis of colorectal carcinoma. Fac Med Baghdad. 2010;52:172-4. https://doi.org/10.32007/jfacmedbagdad.5221016
13. Yang J, Liu Z, Zeng B, Hu G, Gan R. Epstein–Barr virus-associated gastric cancer: a distinct subtype. Cancer letters. 2020 Dec 28;495:191-9. https://doi.org/10.1016/j.canlet.2020.
14. Ramos MFKP, Pereira MA, de Mello ES, dos Santos Cirqueira C, Zilberstein B, Alves VAF, et al. Gastric cancer molecular classification based on immunohistochemistry and in situ hybridization: Analysis in western patients after curative-intent surgery. World Journal of Clinical Oncology. 2021;12(8):688. https://doi.org/10.5306/wjco.v12.i8.688
15. Ratti M, Lampis A, Hahne JC, Passalacqua R, Valeri N. Microsatellite instability in gastric cancer: molecular bases, clinical perspectives, and new treatment approaches. Cellular and Molecular Life Sciences. 2018;75:4151-62. https://doi.org/10.1007/s00018-018-2906-9
16. Grosser B, Kohlruss M, Slotta-Huspenina J, Jesinghaus M, Pfarr N, Steiger K, et al. Impact of tumor localization and molecular subtypes on the prognostic and predictive significance of p53 expression in gastric cancer. Cancers. 2020 Jun 25;12(6):1689. https://doi.org/10.3390/cancers12061689
17. Hwang HJ, Nam SK, Park H, Park Y, Koh J, Na HY, et al. Prediction of TP53 mutations by p53 immunohistochemistry and their prognostic significance in gastric cancer. Journal of pathology and translational medicine. 2020 Jul 1;54(5):378-86. https://doi.org/10.4132/jptm.2020.06.01
18. Kim KW, Kim N, Choi Y, Kim WS, Yoon H, Shin CM, et al. Different effects of p53 protein overexpression on the survival of gastric cancer patients according to Lauren histologic classification: a retrospective study. Gastric Cancer. 2021 Jul;24:844-57. https://doi.org/10.1007/s10120-021-01163-y
19. Zhang X, Wang M, Wang Y, Cheng X, Jiang Y, Xiao H. Clinicopathologic significance of Her-2 and P53 expressions in gastric cancer. Asian Journal of Surgery. 2023;46(1):526-31. https://doi.org/10.1016/j.asjsur.2022.06.039
20. Karpińska-Kaczmarczyk K, Lewandowska M, Ławniczak M, Białek A, Urasińska E. Expression of mismatch repair proteins in early and advanced gastric cancer in Poland. Medical Science Monitor: International Medical Journal of Experimental and Clinical Research. 2016;22:2886. https://doi.org/10.12659/MSM.897150
21. Hanon BM, Mohammad NAA-M, Mahmood AS. The Correlation Between Microsatellite Instability and the Features of Sporadic Colorectal Cancer in Sample of Iraqi Patients. Journal: Journal Of Advances In Biotechnology.4(1). https://doi.org/110.24297/jbt.v4i1.1632
22. Tanabe H, Mizukami Y, Takei H, Tamamura N, Omura Y, Kobayashi Y, et al. Clinicopathological characteristics of Epstein–Barr virus and microsatellite instability subtypes of early gastric neoplasms classified by the Japanese and the World Health Organization criteria. The Journal of Pathology: Clinical Research. 2021;7(4):397-409. https://doi.org/10.1002/cjp2.209
23. Reitsam NG, Märkl B, Dintner S, Waidhauser J, Vlasenko D, Grosser B. Concurrent loss of MLH1, PMS2 and MSH6 immunoexpression in digestive system cancers indicating a widespread dysregulation in DNA repair processes. Frontiers in Oncology. 2022;12:1019798. https://doi.org/10.3389/fonc.2022.1019798
24. Evaristo G, Katz A, Ramírez-GarcíaLuna JL, Issac MS, Sangwan V, Thai D-V, et al. Relation between mismatch repair status, chemoresponse, survival and anatomic location in gastroesophageal adenocarcinoma. Canadian Journal of Surgery. 2023;66(1):E79. https://doi.org/10.1503/cjs.017021
25. Zhang L, Wang Y, Li Z, Lin D, Liu Y, Zhou L, et al. Clinicopathological features of tumor mutation burden, Epstein-Barr virus infection, microsatellite instability and PD-L1 status in Chinese patients with gastric cancer. Diagnostic Pathology. 2021;16(1):38. https://doi.org/10.1186/s13000-021-01099-y
26. Elrefaey HA, Mohamed DA, Al-Azim MAA-HA, El-Shorbagy SH, Helal DS. Microsatellite Instability and P53 Aberrant Expression in Gastric Adenocarcinoma: Immunohistochemical Assessment and Correlation with Clinico-pathological Characteristics. Journal of Advances in Medicine and Medical Research. 2023;35(14):21-42. https://doi.org/10.9734/jammr/2023/v35i145052
التنزيلات
منشور
إصدار
القسم
الرخصة
الحقوق الفكرية (c) 2024 Ali M.J Al-Shakarchi, Sazan A. M. Alatrooshi

هذا العمل مرخص بموجب Creative Commons Attribution 4.0 International License.











 Creative Commons Attribution 4.0 International license..
Creative Commons Attribution 4.0 International license..


