أريستين بيتا 2 كمؤشر محتمل للورم لتشخيص سرطان البروستات وارتباطه بالعناصر الندرة
DOI:
https://doi.org/10.32007/jfacmedbaghdad2476الكلمات المفتاحية:
jالملخص
الخلاصة:
خلفية البحث:
السبب الثاني الرئيسي للوفيات المرتبطة بالسرطان بين الذكور في الولايات المتحدة هو سرطان البروستات (PCa)، وهو أكثر أنواع الأورام الخبيثة غير الجلدية تشخيصًا. يتحكم بروتين الهيكل متعدد الأدوار β-arrestin 2 في عملية نقل الإشارة واستيعاب مستقبلات البروتين G النشطة المقترنة. السرطان هو مجرد واحد من العديد من الاضطرابات التي قد يكون لها ارتباط باختلافات في تركيزات العناصر الندرة.
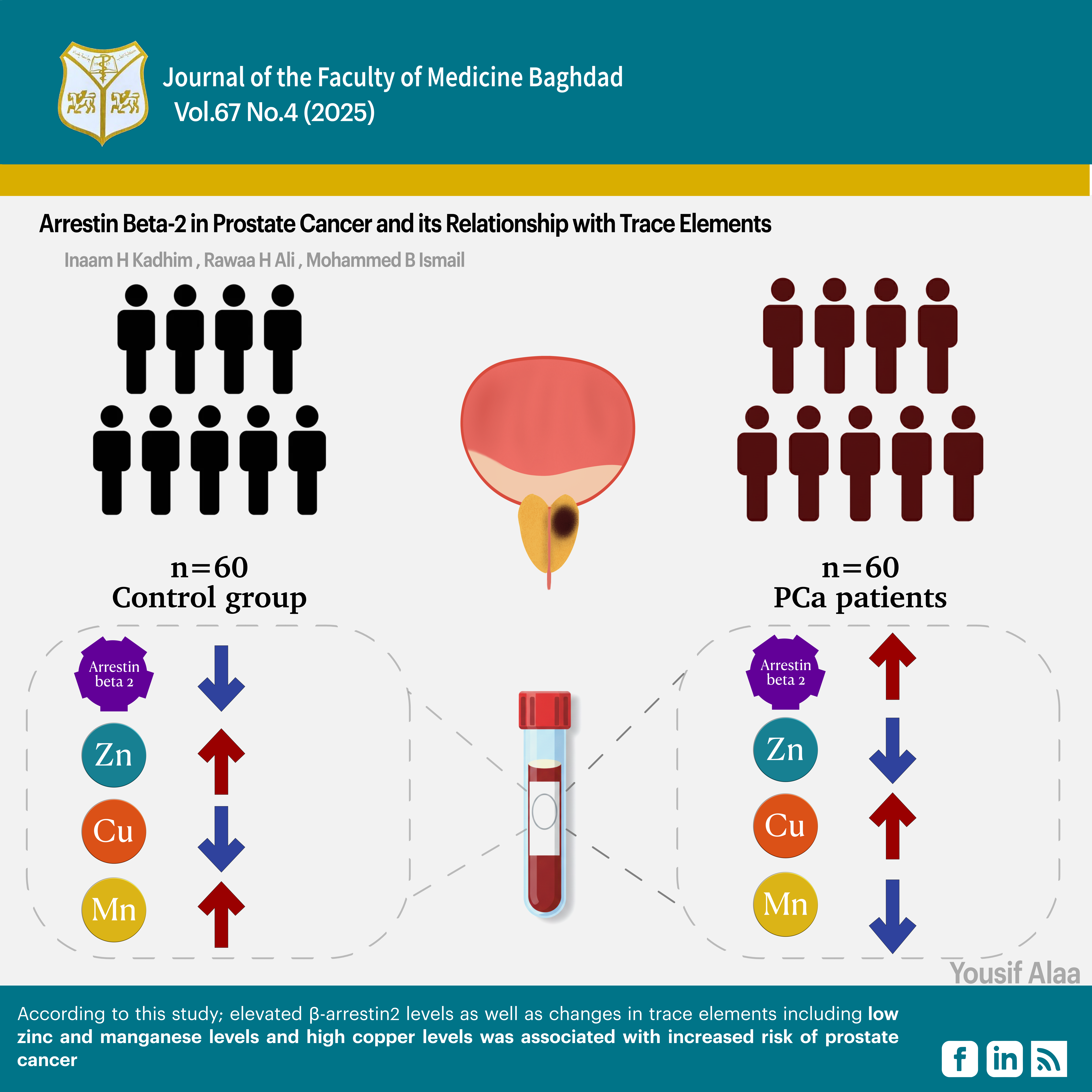
الأهداف: تم تصميم هذه الدراسة لتقييم العلاقة بين β-arrestin 2 في المصل والعناصر الندرة كعلامة ورم لسرطان البروستات.
المرضى وطرق العمل /المواد وطرق العمل: أجريت دراسة الحالة والشاهد هذه في قسم الكيمياء الحيوية، كلية الطب، جامعة بغداد وفي قسم المسالك البولية، مستشفى غازي الحريري للتخصص الجراحي خلال الفترة من مارس 2022 إلى مايو 2023. كان هناك 120 مريضًا من الذكور في المجموع، 60 منهم تلقوا للتو تشخيصًا بسرطان البروستات الأولي (PCa)، وبدا أن 60 منهم يتمتعون بصحة جيدة. تم قياس بيتا أريستين 2 في المصل باستخدام اختبار الممتز المناعي المرتبط بالإنزيم (ELISA)، في حين تم قياس المعادن الندرة مثل الزنك والنحاس والمنغنيز باستخدام مطياف الامتصاص الذري اللهبي.
النتائج: ظهرت نتائج الدراسة الحالية أن مستويات β-arrestin 2 تختلف بشكل كبير بين المجموعة الضابطة ومرضى سرطان البروستات. كما تبين أن مستوى النحاس كان أعلى في المرضى عند مقارنته بالمجموعة االضابطة مع وجود اختلاف إحصائي كبير، كما أظهرت أيضًا أن مستويات الزنك والمنغنيز كانت أعلى في المجموعة االضابطة مقارنة بمجموعة المرضى مع وجود اختلاف إحصائي كبير.
الاستنتاج: وفقًا للنتائج التي تم الحصول عليها، يمكننا أن نقترح أن المستويات الأعلى من بيتا أريستين 2 والنحاس مع انخفاض مستويات الزنك والمنغنيز قد تكون مرتبطة بخطر الإصابة بسرطان البروستات.
التنزيلات
المراجع
1. Kadhim IH, Ali RH, Ismail MB. Ceramide As A Potential Tumor Marker For Diagnosis Of Prostate Cancer And Its Association With Lipid Profile. SEEJPH. 2024; 24special(52): 520 https://doi.org/10.70135/seejph.vi.1012. DOI: https://doi.org/10.70135/seejph.vi.1012
2. Rebello RJ, Oing C, Knudsen KE, Loeb S, Johnson DC, Reiter RE, et al. Prostate Cancer Nat Rev Dis Primers. 2021; 7 (1): 9. https://doi.org/10.1038/s41572-020-00243-0. DOI: https://doi.org/10.1038/s41572-020-00243-0
3. Kallifatidis G, Mamouni K, Lokeshwar BL. The role of β-arrestins in regulating stem cell phenotypes in normal and tumorigenic cells. Int J Mol Sci. 2020;21(23):9310. https://doi.org/10.3390/ijms21239310. DOI: https://doi.org/10.3390/ijms21239310
4. allifatidis G, Smith DK, Morera DS, Gao J, Hennig MJ, Hoy JJ, et al. β-Arrestins regulate stem cell-like phenotype and response to chemotherapy in bladder cancer. Mol Cancer Ther. 2019;18(4):801-11. https://doi.org/10.1158/1535-7163.MCT-18-1167. DOI: https://doi.org/10.1158/1535-7163.MCT-18-1167
5. Kee TR, Khan SA, Neidhart MB, Masters BM, Zhao VK, Kim YK, et al. The multifaceted functions of β-arrestins and their therapeutic potential in neurodegenerative diseases. Exp Mol Med. 2024;56(1):129-41. https://doi.org/10.1038/s12276-023-01144-4. DOI: https://doi.org/10.1038/s12276-023-01144-4
6. Habrowska-Górczyńska DE, Kozieł MJ, Kowalska K, Piastowska-Ciesielska AW. FOXO3a and its regulators in prostate cancer. Int J Mol Sci. 2021;22(22):12530. https://doi.org/10.3390/ijms222212530. DOI: https://doi.org/10.3390/ijms222212530
7. Chasapis CT, Ntoupa PSA, Spiliopoulou CA, Stefanidou ME. Recent aspects of the effects of zinc on human health. Arch Toxicol. 2020; 94:1443-60. https://doi.org/10.1007/s00204-020-02702-9. DOI: https://doi.org/10.1007/s00204-020-02702-9
8. Golonka RM, Xiao X, Abokor AA, Joe B, Vijay-Kumar M. Altered nutrient status reprograms host inflammation and metabolic health via gut microbiota. J Nutr Biochem. 2020; 80:108360. https://doi.org/10.1016/j.jnutbio.2020.108360. DOI: https://doi.org/10.1016/j.jnutbio.2020.108360
9. Ahmed NI, Ali RH, Ismail MB. Kidney functions and electrolyte disturbance among Iraqi patients with bladder cancer. J Fac Med Baghdad [Internet]. 2023 Jan. https://doi.org/10.32007/jfacmedbagdad.6441985. DOI: https://doi.org/10.32007/jfacmedbagdad.6441985
10. Li D, Stovall DB, Wang W, Sui G. Advances of zinc signaling studies in prostate cancer. Int J Mol Sci. 2020;21(2):667. https://doi.org/10.3390/ijms21020667. DOI: https://doi.org/10.3390/ijms21020667
11. Tang D, Chen X, Kroemer G. Cuproptosis: a copper-triggered modality of mitochondrial cell death. Cell Res. 2022;32(5):417-8. https://doi.org/10.1038/s41422-022-00653-7. DOI: https://doi.org/10.1038/s41422-022-00653-7
12. Lu Y, Su H, Wang Y, Li H. Micronutrients and risks of three main urologic cancers: A Mendelian randomization study. Front Nutr. 2023; 10:1016243. https://doi.org/10.3389/fnut.2023.1016243. DOI: https://doi.org/10.3389/fnut.2023.1016243
13. Saleh SAK, Adly HM, Abdelkhaliq AA, Nassir AM. Serum levels of selenium, zinc, copper, manganese, and iron in prostate cancer patients. Curr Urol. 2020;14(1):44-9. https://doi.org/10.1159/000499261. DOI: https://doi.org/10.1159/000499261
14. Baidya M, Kumari P, Dwivedi‐Agnihotri H, Pandey S, Chaturvedi M, Stepniewski TM, et al. Key phosphorylation sites in GPCRs orchestrate the contribution of β‐Arrestin 1 in ERK 1/2 activation. EMBO Rep. 2020;21(9): e49886. https://doi.org/10.15252/embr.201949886. DOI: https://doi.org/10.15252/embr.201949886
15. Hu S, Wang D, Wu J, Jin J, Wei W, Sun W. Involvement of β-arrestins in cancer progression. Mol Biol Rep. 2013; 40:1065-71. https://doi.org/10.1007/s11033-012-2148-0. DOI: https://doi.org/10.1007/s11033-012-2148-0
16. Lakshmikanthan V, Zou L, Kim JI, Michal A, Nie Z, Messias NC, et al. Identification of βArrestin2 as a corepressor of androgen receptor signaling in prostate cancer. Proc Natl Acad Sci. 2009;106(23):9379-84. https://doi.org/10.1073/pnas.0900258106. DOI: https://doi.org/10.1073/pnas.0900258106
17. Wu S, Li M, Chen F, Zeng Y, Xu C. Inhibition of β2-adrenergic receptor regulates necroptosis in prostate cancer cell. Heliyon. 2024;10(11). https://doi.org/10.1016/j.heliyon.2024.e31865. DOI: https://doi.org/10.1016/j.heliyon.2024.e31865
18. Lin YH, Lin YC, Chen CC. Lysophosphatidic acid receptor antagonists and cancer: the current trends, clinical implications, and trials. Cells. 2021;10(7):1629. https://doi.org/10.3390/cells10071629. DOI: https://doi.org/10.3390/cells10071629
19. Kim WK, Lee Y, Jang SJ, Hyeon C. Kinetic model for the desensitization of G protein-coupled receptor. J Phys Chem Lett. 2024;15:6137-45. https://doi.org/10.1021/acs.jpclett.4c00967. DOI: https://doi.org/10.1021/acs.jpclett.4c00967
التنزيلات
منشور
إصدار
القسم
الفئات
الرخصة
الحقوق الفكرية (c) 2025 Inaam H. Kadhim, Rawaa H. Ali, Mohammed B. Ismaeel

هذا العمل مرخص بموجب Creative Commons Attribution 4.0 International License.











 Creative Commons Attribution 4.0 International license..
Creative Commons Attribution 4.0 International license..


