من سطح الحرق إلى مجرى الدم: الأهمية السريرية لبكتيريا Pseudomonas aeruginosa و Acinetobacter baumannii في تجرثم الدم المرتبط بالحروق في الناصرية
DOI:
https://doi.org/10.32007/jfacmedbaghdad3204الكلمات المفتاحية:
الكلمات المفتاحية: مرضى الحروق، الزائفة الزنجارية، المتقلبة البومانية، مقاومة المضادات الحيوية، عدوى المستشفيات.الملخص
من سطح الحرق إلى مجرى الدم: األهمية السريرية لبكتيريا Pseudomonas aeruginosa و Acinetobacter baumannii في تسمم الدم المرتبط بالحروق في مستشفى الناصرية
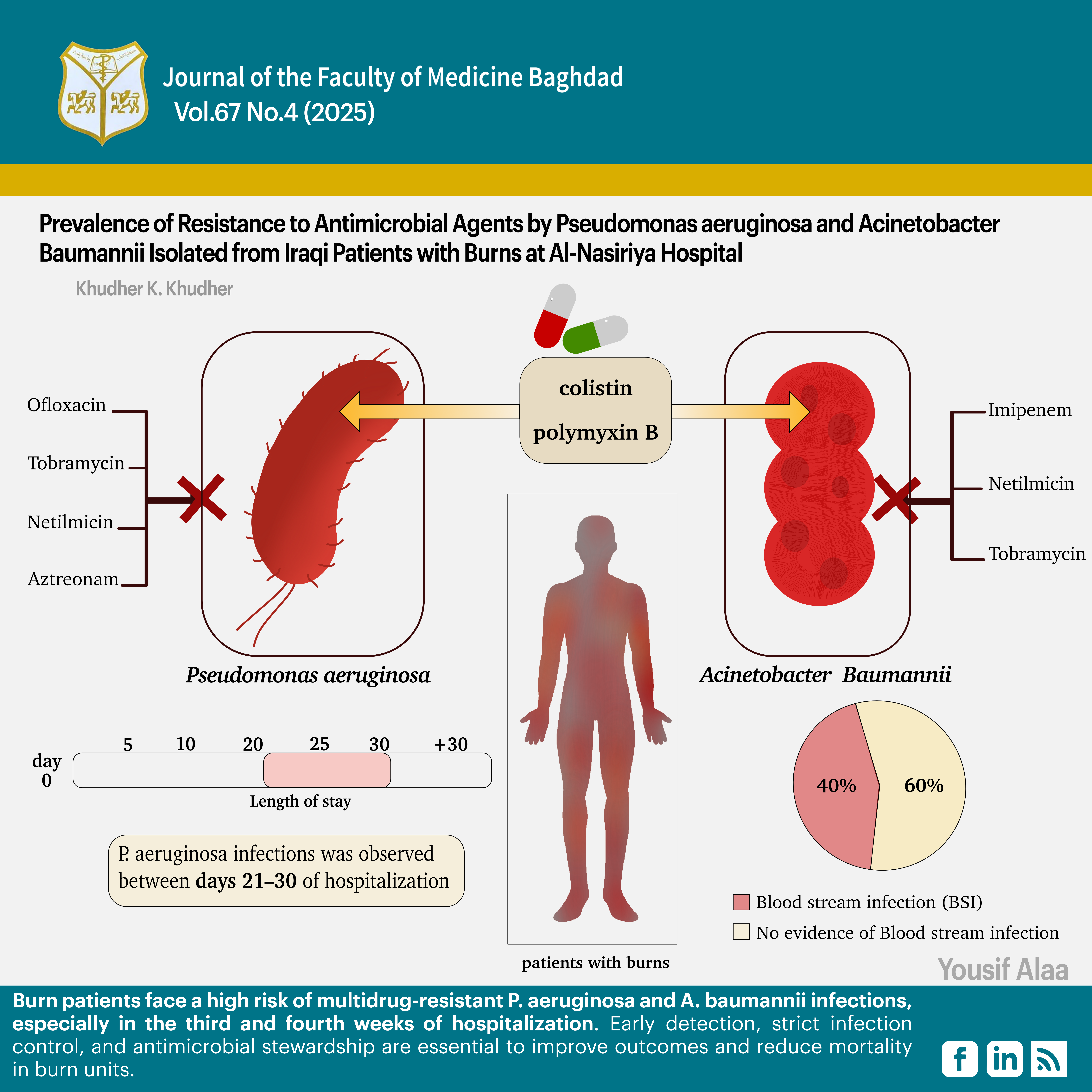
الخلفية: تؤدي إصابات الحروق إلى إضعاف الحاجز الجلدي وتهبيط الدفاعات المناعية، مما يجعل المرضى عرضة للإصابة بعدوى جراثيم سالبة الجرام انتهازية ومقاومة للأدوية. تؤكد هذه النتائج الحاجة الملحة إلى تبني استراتيجيات وقائية وعلاجية موجهة في وحدات رعاية الحروق.
الهدف: تقييم معدل الانتشار، وأنماط المقاومة للمضادات الحيوية، والأهمية السريرية لبكتيريا Pseudomonas aeruginosa وAcinetobacter baumannii لدى مرضى الحروق في مستشفى الناصرية التعليمي – العراق، مع التركيز على توقيت الإصابة، والاختلافات المرتبطة بالجنس، ومستويات المقاومة الدوائية.
الطريقة: أجريت دراسة مستقبلية وصفية خلال الفترة من نيسان 2024 إلى نيسان 2025، حيث تم جمع 150 عينة سريرية من مرضى الحروق ومعالجتها وفقاً للطرق الميكروبيولوجية القياسية. تم التعرف على العزلات وإجراء اختبار الحساسية للمضادات الحيوية وفقاً لتعليمات CLSI. تم تحليل توقيت الإصابة، والبيانات السكانية، والعرض السريري لتحديد فترات الخطورة العالية والأنماط الوبائية.
النتائج: تم الحصول على 80 عزلة بكتيرية: P. aeruginosa (n=48)، A. baumannii (n=19)، و13 حالة عدوى مزدوجة. وظهر ارتفاع واضح في حالات P. aeruginosa خلال الفترة من اليوم 21–30 من الرقود في المستشفى، مما يشير إلى مرحلة حرجة لانتقال العدوى داخل المستشفى. ولوحظ اختلاف في نمط العدوى بـA. baumannii بين الجنسين؛ حيث ظهرت الإصابة في الإناث مبكراً، بينما ظهرت في الذكور لاحقاً خلال فترة الرقود. شكلت عدوى مجرى الدم 40% من الحالات، وكانت P. aeruginosa أكثر انتشاراً بشكل معنوي من A. baumannii (p<0.05). أظهرت A. baumannii مقاومة تامة للإيميپنيم، والتوبراميسين، والنيتيلميسين، بينما أظهرت P. aeruginosa مقاومة بنسبة 100% للتوبراميسين والنيتيلميسين، وأكثر من 97% للأوفلوكساسين والأزتريونام. واحتفظ كلا الممرضين بحساسية كاملة للكوليستين والبوليميكسين B.
الاستنتاج: يواجه مرضى الحروق خطراً مرتفعاً للإصابة بعدوى P. aeruginosa وA. baumannii متعددة المقاومة، خاصة خلال الأسبوعين الثالث والرابع من الرقود. تُعد الاكتشاف المبكر، وتشديد إجراءات مكافحة العدوى، وترشيد استخدام المضادات الحيوية أموراً ضرورية لتحسين النتائج وخفض معدلات الوفيات في وحدات الحروق.
الكلمات المفتاحية: مرضى الحروق، الزائفة الزنجارية، المتقلبة البومانية، مقاومة المضادات الحيوية، عدوى المستشفيات.
التنزيلات
المراجع
1. Ke Y, Ye L, Zhu P, Zhu Z. The clinical characteristics and microbiological investigation of pediatric burn patients with wound infections in a tertiary hospital in Ningbo, China: A ten-year retrospective study. Frontiers in Microbiology. 2023 ;13 https://doi.org/10.3389/fmicb.2022.1034099 DOI: https://doi.org/10.3389/fmicb.2022.1034099
2. Yang Y, Zeng Q, Hu G, Wang Z, Chen Z, Zhou L, He A, et al. Distribution of Nosocomial Pathogens and Antimicrobial Resistance among Patients with Burn Injuries in China: A Comprehensive Research Synopsis and Meta-Analysis. Infectious Diseases and Therapy. 2024 Jun;13(6):1291-313. https://doi.org/10.1007/s40121-024-00983-6
3. Adeyemi FM, Akinlade EA, Yusuf-Omoloye NA, Ajigbewu OH, Dare AP, Wahab AA, et al. Carbapenem-resistance in Acinetobacter baumannii: prevalence, antibiotic resistance profile and carbapenemase genes in clinical and hospital environmental strains. BMC Infectious Diseases. 2025 Jun 2;25(1):786. https://doi.org/10.1186/s12879-025-11169-x DOI: https://doi.org/10.1186/s12879-025-11169-x
4. Cain AK, Hamidian M. Portrait of a killer: Uncovering resistance mechanisms and global spread of Acinetobacter baumannii. PLoS pathogens. 2023 Aug 10;19(8):e1011520. https://doi.org/10.1371/journal.ppat.1011520 DOI: https://doi.org/10.1371/journal.ppat.1011520
5. Fallon M, Kennedy S, Daniels S, Humphreys H. Plasma-activated liquid as a potential decontaminant in healthcare: assessment of antibacterial activity and use with cleaning cloths. Journal of Hospital Infection. 2024 Mar 1;145:218-23. https://doi.org/10.1016/j.jhin.2024.01.008 DOI: https://doi.org/10.1016/j.jhin.2024.01.008
6. Mcheik JN, Barrault C, Pedretti N, Garnier J, Juchaux F, Levard G, Morel F, Bernard FX, Lecron JC. Study of proliferation and 3D epidermal reconstruction from foreskin, auricular and trunk keratinocytes in children. Burns. 2015 Mar 1;41(2):352-8. DOI: https://doi.org/10.1016/j.burns.2014.07.003
7. Roy S, Mukherjee P, Kundu S, Majumder D, Raychaudhuri V, Choudhury L. Microbial infections in burn patients. Acute and Critical Care. 2024 May ;39(2):214. https://doi.org/10.4266/acc.2023.01571 DOI: https://doi.org/10.4266/acc.2023.01571
8. Kovacic A, Seruga Music M, Dekic S, Tonkic M, Novak A, Rubic Z, Hrenovic J, Goic-Barisic I. Transmission and survival of carbapenem-resistant Acinetobacter baumannii outside hospital setting. Int Microbiol. 2017 Dec;20(4):165-169
https://doi.org/10.2436/20.1501.01.299
9. Hu Y, Li D, Xu L, Hu Y, Sang Y, Zhang G, Dai H. Epidemiology and outcomes of bloodstream infections in severe burn patients: a six-year retrospective study. Antimicrobial Resistance & Infection Control. 2021 Jun 30;10(1):98.
https://doi.org/10.1186/s13756-021-00969-w DOI: https://doi.org/10.1186/s13756-021-00969-w
10. Taee SR, Khansarinejad B, Abtahi H, Najafimosleh M, Ghaznavi-Rad E. Detection of algD, oprL and exoA genes by new specific primers as an efficient, rapid and accurate procedure for direct diagnosis of Pseudomonas aeruginosa strains in clinical samples. Jundishapur journal of microbiology. 2014 Oct 1;7(10):e13583. https://doi.org/10.5812/jjm.13583 DOI: https://doi.org/10.5812/jjm.13583
12. Kafshnouchi M, Safari M, Khodavirdipour A, Bahador A, Hashemi SH, Alikhani MS, Saidijam M, Alikhani MY. Molecular detection of blaOXA-type carbapenemase genes and antimicrobial resistance patterns among clinical isolates of Acinetobacter baumannii. Global medical genetics. 2022 ;9(02):118-23. https://doi.org/10.1055/s-0041-1740019 DOI: https://doi.org/10.1055/s-0041-1740019
13. Özdemir B, Akinci E, Kazancioğlu S, Yasti Aç, Yüksek Yn, Sözen İ, Bodur H. Bloodstream Infections in Severe Burn Patients: Epidemiology, Microbiology, Laboratory Features, and Risk Factors Associated with Mortality. MJIMA. 2022. https://doi.org/10.4274/mjima.galenos.2022.2022.47 DOI: https://doi.org/10.4274/mjima.galenos.2022.2022.47
14. Yang Y, Zeng Q, Hu G, Wang Z, Chen Z, Zhou L, He A, Qian W, Luo Y, Li G. Distribution of Nosocomial Pathogens and Antimicrobial Resistance among Patients with Burn Injuries in China: A Comprehensive Research Synopsis and Meta-Analysis. Infect Dis Ther. 2024;13(6):1291-1313. https://doi.org/10.1007/s40121-024-00983-6 DOI: https://doi.org/10.1007/s40121-024-00983-6
15. Christie M, Avenant T, Nembudani M, Mnqandi A, Muller C, De Villiers M, Bhikhoo Z. Insights into bloodstream infections in South African paediatric burn patients: implications for antimicrobial stewardship. BMC Infectious Diseases. 2025 Mar 14;25(1):362.
https://doi.org/10.1186/s12879-025-10582-6 DOI: https://doi.org/10.1186/s12879-025-10582-6
15. Fleming ID, Tang C, Lewis GM. 620 Outbreak of Carbapenem-Polymyxin-Quat-Resistant Acinetobacter baumannii Associated with Mafenide Acetate shortages: An interdisciplinary approach to eradication. J Burn Care Res. 2021;42(Suppl1):S164-S165. https://doi.org/10.1093/jbcr/irab032.270. DOI: https://doi.org/10.1093/jbcr/irab032.270
16. Benitez JP, Zuluaga M, Trochez JP, Árias ÁA, Penagos DF, Briceño E, et al. Burn wound infections: A 35- year review of advances, diagnostic challenges, and evidence-based strategies. Rev Bras Cir Plast. 2025;40(Suppl 1): s00451809394.
https://doi.org/10.1055/s-0045-1809394. DOI: https://doi.org/10.1055/s-0045-1809394
17. Dubey V, Reza N, Hope W. Drug-resistant Acinetobacter baumannii: mortality, emerging treatments, and future pharmacological targets for a WHO priority pathogen. Clinical Microbiology Reviews. 2025 Sep 11;38(3):e00279-24. https://doi.org/10.1128/cmr.00279-24 DOI: https://doi.org/10.1128/cmr.00279-24
18. Elfadadny A, Ragab RF, AlHarbi M, Badshah F, Ibáñez-Arancibia E, Farag A, et al. Antimicrobial resistance of Pseudomonas aeruginosa: navigating clinical impacts, current resistance trends, and innovations in breaking therapies. Frontiers in microbiology. 2024 Apr 5;15:1374466. https://doi.org/10.3389/fmicb.2024.1374466 DOI: https://doi.org/10.3389/fmicb.2024.1374466
19. Sadeghi M, Mobayen M, Yaghubi Kalurazi T, Mehrdad Z, Gaskarei MK, Moghadam SK, et al . Epidemiological Trends and Evolving Antibiotic Resistance Profiles of Pseudomonas aeruginosa in Burn Patients: A 3‐Year Cross‐Sectional Surveillance in Northern Iran. Health Science Reports. 2025 Jul;8(7):e71054. https://doi.org/10.1002/hsr2.7105417. DOI: https://doi.org/10.1002/hsr2.71054
20. Althaferi RS, Alfouzan WA, Mustafa AS. Antibiotics Resistance Profile of Clinical Isolates of Pseudomonas aeruginosa Obtained from Farwaniya Hospital in Kuwait Using Phenotypic and Molecular Methods. Antibiotics. 2025 May 24;14(6):539. https://doi.org/10.3390/antibiotics14060539 DOI: https://doi.org/10.3390/antibiotics14060539
21. Boushra MR, Gad GF, Hassuna NA, Waly NG, Ibrahem RA. Phenotypic and genotypic assessment of fluoroquinolones and aminoglycosides resistances in Pseudomonas aeruginosa collected from Minia hospitals, Egypt during COVID-19 pandemic. BMC Infectious Diseases. 2024 Jul 31;24(1):763. https://doi.org/10.1186/s12879-024-09605-5 DOI: https://doi.org/10.1186/s12879-024-09605-5
22 Cabot G, Ocampo-Sosa AA, Tubau F, Macia MD, Rodríguez C, Moya B, et al. Overexpression of AmpC and efflux pumps in Pseudomonas aeruginosa isolates from bloodstream infections: prevalence and impact on resistance in a Spanish multicenter study. Antimicrob Agents Chemother. 2011;55(5):1906-1911. https://doi.org/10.1128/AAC.01645-10. DOI: https://doi.org/10.1128/AAC.01645-10
التنزيلات
منشور
إصدار
القسم
الفئات
الرخصة
الحقوق الفكرية (c) 2025 Khudher K. Khudher

هذا العمل مرخص بموجب Creative Commons Attribution 4.0 International License.











 Creative Commons Attribution 4.0 International license..
Creative Commons Attribution 4.0 International license..


