تأثير مختلف العلاجات الطبية على فيتامين D3 و مؤشرات الإجهاد التأكسدي في اللعاب والمصل لدى المرضى العراقيين المصابين بمرض بهجت
DOI:
https://doi.org/10.32007/jfacmedbaghdad3025الكلمات المفتاحية:
مرض بهجت، الأدوية البيولوجية، فيتامين Dالملخص
خلفية: يعد مرض بهجت (BD) أحد الأمراض المناعية الذاتية التي تصيب أجهزة متعددة في الجسم، ويتميز بفترات غير متوقعة من التفاقم والهدوء. يُعتقد أن فيتامين د هو عامل بيئي رئيسي يمكن أن يزيد من احتمالية الإصابة بالعديد من الاضطرابات الالتهابية والمناعة الذاتية، مثل مرض بهجت.
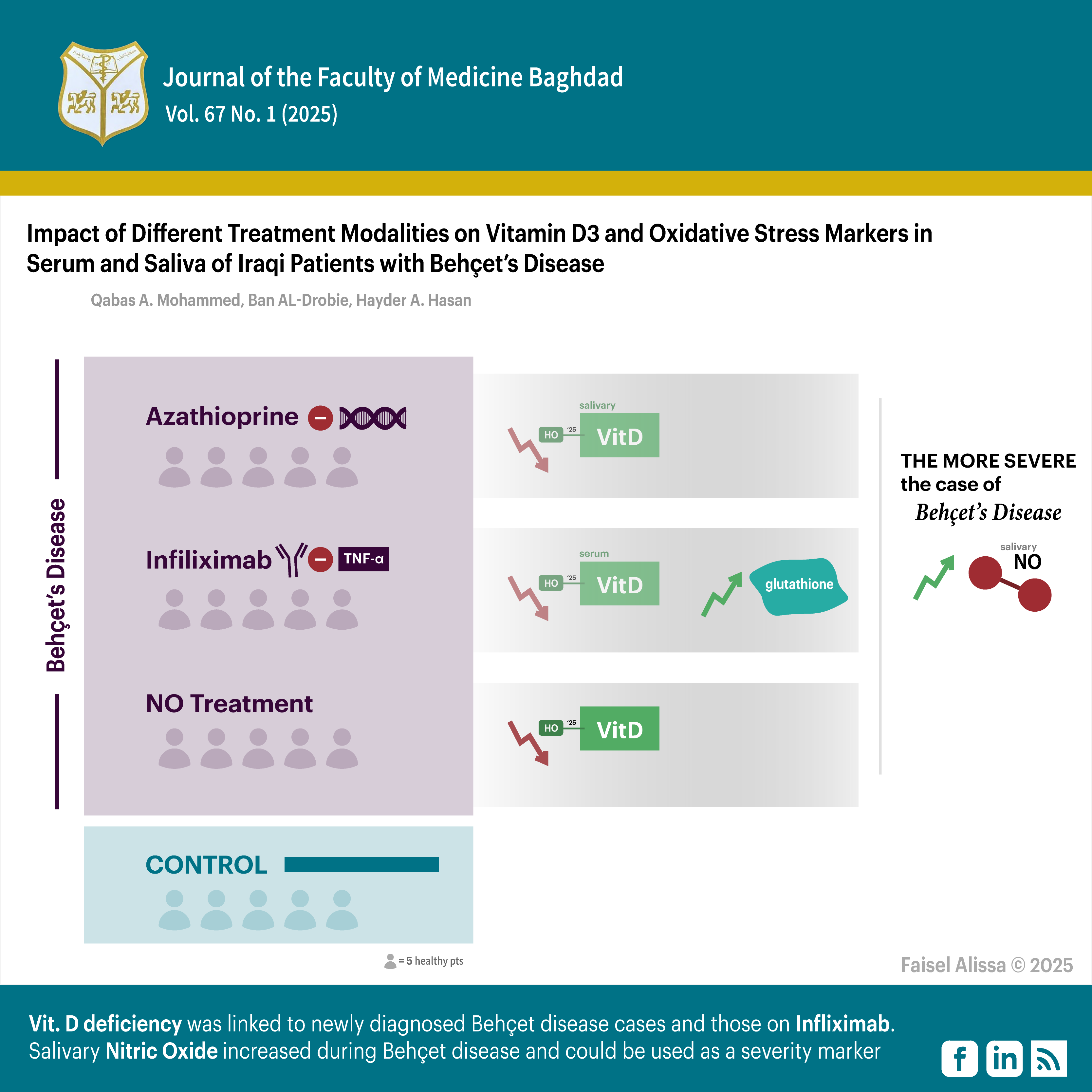
الاهداف: تقييم تأثير العلاج الطبي ومؤشر كتلة الجسم (BMI) على فيتامين D3 وبعض مؤشرات الإجهاد التأكسدي (الجلوتاثيون، أكسيد النيتريك) في اللعاب والمصل لدى المرضى العراقيين المصابين بمرض بهجت (BD) بالإضافة إلى ذلك، استكشاف أي ارتباطات محتملة بين هذه المؤشرات وفيتامين D3 وشدة مرض بهجت، والخاصية المضادة للأكسدة لفيتامين D3، وإمكانية استخدام اللعاب كبديل للمصل في قياس هذه المؤشرات.
المواد وطرق العمل: هذه الدراسة اجريت في مستشفى مرجان التعليمي في بابل بين ديسمبر 2023 ومارس 2024, تم تقسيم خمسة وأربعين مريضًا بمرض بهجت، والذين يستوفون المعايير الدولية، إلى ثلاث مجموعات: 15 مريضًا يتلقون علاج الأزاثيوبرين، 15 حالة تم تشخيصها حديثًا ولم تتلق علاجًا، و15 مريضًا يتلقون العلاج بمضادات TNF-α. تم تضمين مجموعة ضابطة مكونة من 15 فردًا متوافقين مع المرضى في العمر والجنس. تم قياس مستويات فيتامين D (25-هيدروكسي فيتامين د) في المصل واللعاب باستخدام اختبار ELISA. تم استخدام طرق قياس الطيف لتقييم مستويات الجلوتاثيون المخفض (GSH) وأكسيد النيتريك (NO) في المصل واللعاب بين المجموعات.
النتائج: كانت مستويات فيتامين D3 منخفضة بشكل ملحوظ لدى المرضى الذين تم تشخيصهم حديثًا بمرض بهجت وأولئك الذين يتلقون علاجًا بمضادات TNF-α مقارنة مع المجموعة الضابطة (P<0.05). أظهر أكسيد النيتريك في المصل ارتباطًا عكسيًا مع فرق ذو دلالة عالية (P=0.001) فيما يتعلق بشدة المرض.
الاستنتاجات: ارتبطت حالات مرض بهجت التي تم تشخيصها حديثًا وأولئك الذين يتلقون علاجًا بمضادات TNF-α بنقص فيتامين.D كان هناك ارتباط إيجابي بين مستويات فيتامين D3 في المصل واللعاب. ارتفع مستوى أكسيد النيتريك في اللعاب أثناء مرض بهجت. وبما أن مستويات أكسيد النيتريك في المصل تنخفض مع تقدم المرض، فقد يمكن استخدامها كمؤشر لقياس شدة مرض بهجت.
التنزيلات
المراجع
1. Mohammed D, Yas LS. Clinical Assessment and Cytomorphometric Analysis of Buccal Mucosal Cells in Bechts Disease Patients. J Bagh Coll Dent. 2019;31(3):24-8. https://doi.org/10.26477/jbcd.v31i3.2696.
2. Gorial F, Jabbar M. Demographic and clinical characteristics of Behçet’s disease in Iraqi patients. Arch Med Sci Aging. 2021;4:e1-e5. https://doi.org/10.5114/amsa.2021.106113.
3. lhelfi NM, Hobi NM. Influence of Vitamin D Deficiency on the Level of Salivary cathelicidin LL-37 in relation to Dental Caries Experience: A Case-Control Study. Al-Kindy Coll Med J. 2023;19(1):86-9. https://doi.org/10.47723/kcmj.v19i1.906.
4. Oubouchou R, -Djeraba ZAA, Kemikem Y, Otmani F, Touil-Boukoffa C. Immunomodulatory effect of vitamin D supplementation on Behçet’s disease patients: effect on nitric oxide and Th17/Treg cytokines production. Immunopharmacol Immunotoxicol. 2024;46(1):1-10. https://doi.org/10.1080/08923973.2023.2239490.
5. Tran N, Garcia T, Aniqa M, Ali S, Ally A, Nauli SM. Endothelial nitric oxide synthase (eNOS) and the cardiovascular system: in physiology and in disease states. Am J Biomed Sci Res. 2022;15(2):153–77. https://europepmc.org/article/med/35072089
6. Omar HS, Taha FM, Fouad S, Ibrahim FA, El Gendy A, Bassyouni IH, El-Shazly R. The association between vitamin D levels and oxidative stress markers in Egyptian Behcet’s disease patients. Orphanet Journal of Rare Diseases. 2022 Jul 15;17(1):264. https://doi.org/10.1186/s13023-022-02416-4
7. Stepanov YV, Golovynska I, Golovynskyi S, Garmanchuk LV, Gorbach O, Stepanova LI, et al. Red and near infrared light-stimulated angiogenesis mediated via Ca2+ influx, VEGF production and NO synthesis in endothelial cells in macrophage or malignant environments. J Photochem Photobiol B: Biolo. 2022;227:112388. https://doi.org/10.1016/j.jphotobiol.2022.
8. Bilgin R, Dahham RW, Kozanoğlu E, Demir B, Arslan D, Aşık MA, et al. The Effect of Antioxidant Biomolecules in Ankylosing Spondylitis and Behçet’s Diseases. Asian J Res Biochem. 2024;14(5):134-42. https://doi.org/10.9734/ajrb/2024/v14i5319.
9. Madhloom BN, Diajil AR. Oxidative stress status in hypertensive patients on amlodipine treatment. J Bagh Coll Dent. 2020;32:1-8. https://doi.org/10.26477/jbcd.v32i1.2751
10. Ao T, Kikuta J, Ishii M. The effects of vitamin D on immune system and inflammatory diseases. Biomolecules. 2021;11(11):1624. https://doi.org/:10.3390/biom11111624.
11. Sîrbe C, Rednic S, Grama A, Pop TL. An update on the effects of vitamin D on the immune system and autoimmune diseases. Int J Mol Sci. 2022;23(17):9784. https://doi.org/10.3390/ijms23179784.
12. Marí M, de Gregorio E, de Dios C, Roca-Agujetas V, Cucarull B, Tutusaus A, et al. Mitochondrial glutathione: recent insights and role in disease. Antioxidants. 2020;9(10):909. https://doi.org/10.3390/antiox9100909909.
13. Sari DK, Sari LM, Laksmi LI, Farhat F. The Use of 25-hydroxyvitamin D Saliva Test to Replace Vitamin D Serum Blood Test in Healthy People. Open Access Maced J Med Sci. 2021;9:40-3. https://doi.org/10.3889/oamjms.2021.6329.
14. Boroumand M, Olianas A, Cabras T, Manconi B, Fanni D, Faa G, et al. Saliva, a bodily fluid with recognized and potential diagnostic applications. J Sep Sci. 2021;44(19):3677-90. https://doi.org/10.1002/jssc.202100384.
15. Dongiovanni P, Meroni M, Casati S, Goldoni R, Thomaz DV, Kehr NS, et al. Salivary biomarkers: novel noninvasive tools to diagnose chronic inflammation. Int J Oral Sci. 2023;15:27. https://doi.org//10.1038s41368-023-00231-6.
16. Bergamo S. The diagnosis of Adamantiades-Behçet disease: clinical features and diagnostic/classification criteria. Front Med. 2022;9:1098351. https://doi.org/10.3389/fmed.2022.1098351.
17. Jayashri R, Venkatesan U, Shanthirani CS, Deepa M, Anjana RM, Mohan V, et al. Prevalence of vitamin D deficiency in urban south Indians with different grades of glucose tolerance. Br J Nutr. 2020;124(2):209-16. https://doi.org/10.1017/S0007114520001129.
18. Demirbaş A, Elmas ÖF, Demirbaş GU, Atasoy M, Türsen Ü, Lotti T. Potential utility of oral mucosal capillaroscopy as an indicator of microvascular damage in behcet disease: a preliminary study. Dermatol Pract Concept. 2021;11(4):e2021116. https://doi.org/10.5826/dpc.1104a116.
19. Mekawy DM, Eissa M, Sadik NA, Abd-Elrahman RM, Fawzy A, Amer MF. Vitamin D and miRNA-155 in Behçet’s Disease: Possible Association with the Disease and Disease Activity. Reports of Biochemistry & Molecular Biology. 2023 Jul;12(2):251. https://doi.org/10.61186/rbmb.12.2.251
20. Ganzetti G, Campanati A, Scocco V, Brugia M, Tocchini M, Liberati G, et al. The potential effect of the tumour necrosis factor-α inhibitors on vitamin D status in psoriatic patients. Acta Derm Venereol. 2014;94:715-7. https://doi.org/10.2340/00015555-1801.
21. Cui A, Zhang T, Xiao P, Fan Z, Wang H, Zhuang Y. Global and regional prevalence of vitamin D deficiency in population-based studies from 2000 to 2022: A pooled analysis of 7.9 million participants. Front Nutr. 2023;10:1070808. https://doi.org/10.3389/fnut.2023.
22. Jhamb JA, Rampal S, Jaiman A, Sinniah A, Tong JB, Jaiman A. Worsening air pollution an unfamiliar cause of low vitamin D levels: a systematic literature review. J Clin Med Kazakhstan. 2023;20(5):4-8. https://doi.org/10.23950/jcmk/13760.
23. Al-Yatama FI, AlOtaibi F, Al-Bader MD, Al-Shoumer KA. The effect of clothing on vitamin D status, bone turnover markers, and bone mineral density in young Kuwaiti females. Int J Endocrinol. 2019;2019:10. https://doi.org/10.1155/2019/6794837.
24. Hadjimi Z, Belguendouz H, Benchabane S, Ghozali NEH, Amri M, Kocheida R, et al. Increased salivary cytokines and nitric oxide levels in Behçet’s disease: interleukin-32, a novel player in disease prognosis. Endocr Metab Immune Disord Drug Targets. 2023;23(3):. https://doi.org/10.2174/1871530322666220512120948347-355.
25. van der Houwen T, van Laar J. Behҫet’s disease, and the role of TNF-α and TNF-α blockers. Int J Mol Sci. 2020;21:3072. https://doi.org/10.390/ijms21093072.
26. Checa J, Aran JM. Reactive oxygen species: drivers of physiological and pathological processes. J Inflamm Res. 2020;13:1057-73. https://doi.org/10.2147/JIR.S275595.
27. Jang D-i, Lee A-H, Shin H-Y, Song H-R, Park J-H, Kang T-B, et al. The role of tumor necrosis factor alpha (TNF-α) in autoimmune disease and current TNF-α inhibitors in therapeutics. International J Mol Sci. 2021;22:2719. https://doi.org/10.3390/ijms22052719.
28. Liu T, Sun L, Zhang Y, Wang Y, Zheng J. Imbalanced GSH/ROS and sequential cell death. J Biochem Mol Toxicol. 2022;36(1):e22942. https://doi.org/10.1002/jbt.
29. Shalkami A-GS, El-Shoura EA, Hassan MI. Carvedilol alleviates the detrimental effects of azathioprine on hepatic tissues in experimental rats: Focusing on redox system, inflammatory and apoptosis pathways. Hum Exp Toxicol. 2024;43:1-10. https://doi.org/10.1177/09603271241269003.
30. Bahramian A, Falsafi P, Abbasi T, Ghanizadeh M, Abedini M, Kavoosi F, et al. Comparing serum and salivary levels of vitamin D in patients with recurrent aphthous stomatitis and healthy individuals. J Dent. 2018;19:295. https://doi.org/10.30476/dentjods.2018.41826
31. Perazzio SF, Andrade LE, De Souza AW. Understanding Behçet’s disease in the context of innate immunity activation. Front Immunol. 2020;11:586558. https://doi.org/10.3389/fimmu.2020.
32. Fadini G, Tognon S, Rodriguez L, Boscaro E, Baesso I, Avogaro A, et al. Low levels of endothelial progenitor cells correlate with disease duration and activity in patients with Behçet's disease. Clin Exp Rheumatol. 2009;27(5):814-21. https://www.ncbi.nlm.nih.gov/pubmed/19917165
33. Hanel A, Carlberg C. Vitamin D and evolution: Pharmacologic implications. Biochem Pharmacol. 2020;173:113595. https://doi.org/10.1016/j.bcp.2019.07.024.
34. Ansari MGA, Sabico S, Clerici M, Khattak MNK, Wani K, Al-Musharaf S, et al. Vitamin D supplementation is associated with increased glutathione peroxidase-1 levels in Arab adults with prediabetes. Antioxidants. 2020;9:118. https://doi.org/10.3390/antiox9020118.
35. Szymczak-Pajor I, Drzewoski J, Śliwińska A. The molecular mechanisms by which vitamin D prevents insulin resistance and associated disorders. Int J Mol Sci. 2020;21(18):6644. https://doi.org/10.3390/ijms21186644.
36. Gu JC, Wu YG, Huang WG, Fan XJ, Chen XH, Zhou B, et al. Effect of vitamin D on oxidative stress and serum inflammatory factors in the patients with type 2 diabetes. J Clin Lab Anal. 2022;36(5):e24430. https://doi.org/10.1002/jcla.
37. Evereklioglu C, Turkoz Y, Er H, Inaloz HS, Ozbek E, Cekmen M. Increased nitric oxide production in patients with Behçet's disease: is it a new activity marker? J Am Acad Dermatol. 2002;46:50-4. https://doi.org/10.1067/mjd.2002.118338.
38. Sahin M, Arslan C, Naziroglu M, Tunc SE, Demirci M, Sutcu R, et al. Asymmetric dimethylarginine and nitric oxide levels as signs of endothelial dysfunction in Behcet’s disease. Ann Clin Lab Sci. 2006;36(4):449-54. http://www.annclinlabsci.org/content/36/4/449.short
39. Diachkova E, Trifonova D, Morozova E, Runova G, Ashurko I, Ibadulaeva M, et al. Vitamin D and its role in oral diseases development. Scoping review. Dent J. 2021;9(11):129. https://doi.org/10.3390/dj9110129.
40. Kao T-W, Lu I-S, Liao K-C, Lai H-Y, Loh C-H, Kuo H-K. Associations between body mass index and serum levels of C-reactive protein. S Afr Med J. 2009;99:326-30. https://www.ajol.info/index.php/samj/article/view/50761
التنزيلات
منشور
إصدار
القسم
الرخصة
الحقوق الفكرية (c) 2025 Qabas A. Mohammed, Ban AL-Drobie, Hayder A. Hasan

هذا العمل مرخص بموجب Creative Commons Attribution 4.0 International License.











 Creative Commons Attribution 4.0 International license..
Creative Commons Attribution 4.0 International license..


