دور البروتين الدهني في الدم أ والبروتين الدهني منخفض الكثافة والكوليسترول كعلامات لاعتلال الشبكية التكاثري وغير التكاثري لدى المرضى المصابين بداء السكري من النوع الثاني
DOI:
https://doi.org/10.32007/jfacmedbaghdad2942الكلمات المفتاحية:
البروتين الدهني منخفض الكثافة صغير الكثافة، اعتلال الشبكية السكري التكاثري، اعتلال الشبكية السكري غير التكاثريالملخص
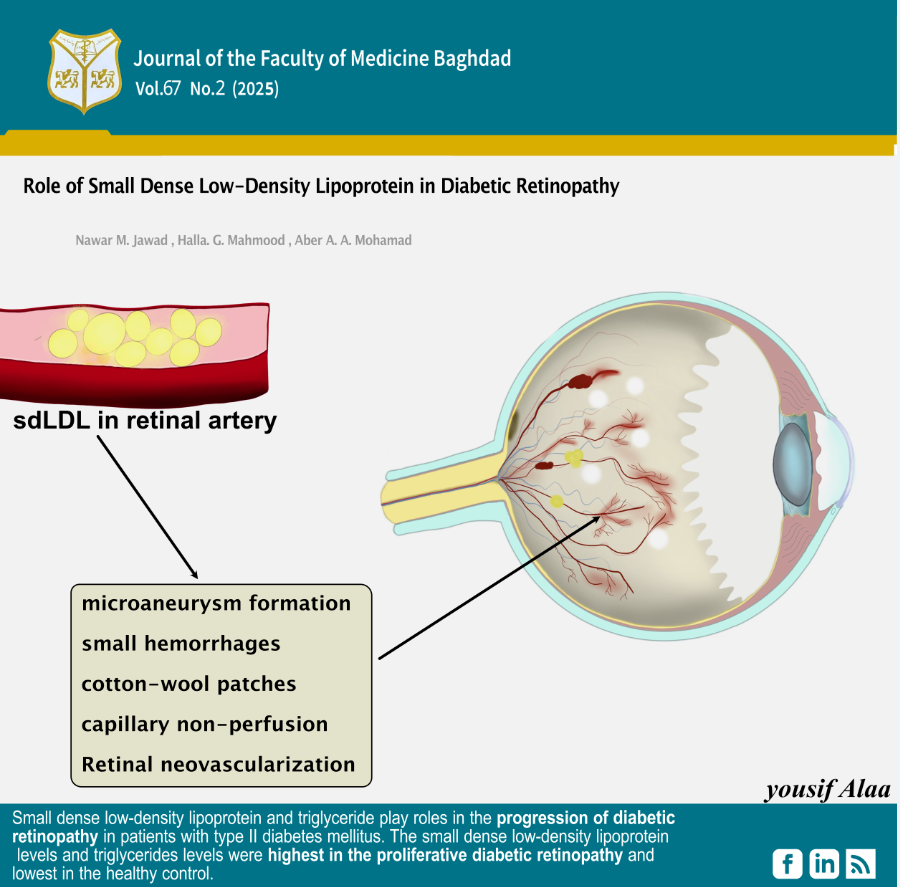
الخلفية: اعتلال الشبكية السكري هو النتيجة العينية الأولية لمرض السكري، وهو مرض خطير معروف أنه يؤثر على الصحة العالمية بشكل كبير. مضاعفات الأوعية الدموية الدقيقة، التي تنشأ من تلف شرايين الدم الصغيرة، ومضاعفات الأوعية الدموية الكبيرة، التي تنشأ من تلف الأوعية الدموية الكبيرة، هما المضاعفتان الوعائيتان المعترف بهما تقليديًا لمرض السكري. يعد اعتلال الشبكية واعتلال الكلية واعتلال عضلة القلب والاعتلال العصبي أمثلة على آليات تلف الأوعية الدموية الدقيقة. توجد نتائج غير متناسقة في الأبحاث الوبائية التي تدرس على وجه التحديد مستويات الدهون واعتلال الشبكية السكري. جزيئات البروتين الدهني منخفض الكثافة الصغيرة الكثيفة هي مجموعة فرعية محددة من البروتين الدهني منخفض الكثافة الذي يمتلك العديد من الخصائص المؤيدة لتصلب الشرايين. وتشمل هذه مستوى أكبر من الاحتفاظ في جدار الشرايين، وانخفاض امتصاص المستقبلات، وإطالة عمر النصف في مجرى الدم، وزيادة الارتباط بالبروتيوغليكان، وانخفاض مقاومة الأكسدة. تشير هذه النتائج إلى أن جزيئات البروتين الدهني منخفض الكثافة ذات الكثافة الصغيرة هي علامة حيوية متفوقة بكثير مقارنة بالبروتين الدهني منخفض الكثافة في البلازما في تقييم خطر اعتلال الشبكية..
الطريقة: أجريت الدراسة على (١٦٠) شخصًا تم تقسيمهم إلى أربع مجموعات: (٤٠) مريضًا يعانون من اعتلال الشبكية السكري غير التكاثري(NPDR)، (٤٠) مريضًا يعانون من اعتلال الشبكية السكري التكاثري(PDR)، (٤٠) مريضًا مصابًا بالسكري غير مصابين باعتلال الشبكية السكري(NODR) و (٤٠) شخصًا سليمًا. قامت الدراسة بقياس مستوى البروتين الدهني منخفض الكثافة والصغير والكثيف والكوليسترول والدهون الثلاثية في مصل الدم.
النتائج: كشفت الدراسة أن مستويات البروتين الدهني منخفض الكثافة صغير الكثافة في مجموعة اعتلال الشبكية السكري التكاثري كانت أعلى بكثير من تلك الموجودة في اعتلال الشبكية السكري غير التكاثري، والسكري دون اعتلال الشبكية، ومجموعات المراقبة الصحية.
الاستنتاج: إن البروتين الدهني منخفض الكثافة والصغير والكثيف يلعب دورًا في تطور اعتلال الشبكية السكري لدى مرضى السكري من النوع الثاني. وكانت مستويات البروتين الدهني منخفض الكثافة والصغير والكثيف أعلى في مجموعة اعتلال الشبكية السكري التكاثري وأدنى في مجموعة التحكم الصحية. وكان لدى مجموعة اعتلال الشبكية السكري التكاثري أعلى مستوى متوسط للدهون الثلاثية، بينما كان لدى مجموعة التحكم الصحية أدنى مستوى متوسط للدهون الثلاثية.
الكلمات المفتاحية: البروتين الدهني منخفض الكثافة صغير الكثافة؛ اعتلال الشبكية السكري التكاثري؛ اعتلال الشبكية السكري غير التكاثري؛ المرضى المصابين بالسكري و غير مصابين باعتلال الشبكية.
المراجع
1. Antonetti DA, Silva PS, Stitt AW. Current understanding of the molecular and cellular pathology of diabetic retinopathy. Nature Reviews Endocrinology. 2021;17:195-206. https://doi.org/10.1038/s41574-020-00451-4.
2. Kropp M, Golubnitschaja O, Mazurakova A, et al. Diabetic retinopathy as the leading cause of blindness and early predictor of cascading complications—risks and mitigation. EPMA Journal. 2023;14:21-42. https://doi.org/10.1007/s13167-023-00314-
3. Zhou J, Chen B. Retinal cell damage in diabetic retinopathy. Cells. 2023;12(9):1342. https://doi.org/10.3390/cells12091342.
4. Albadr A, Haddad NS. Pancreatic Stone Protein/regenerating Protein (PSP/reg) as a Biochemical Marker for prediction of Microvascular Complications of Type 2 Diabetes Mellitus. KCMJ. 2023;19(2):196-201. https://doi.org/10.47723/kcmj.v19i2.966.
5. Szczechla M, Balewska A, Naskręt D, Zozulińska-Ziółkiewicz D, Uruska A. Molecular Changes in Cells of Patients with Type 2 Diabetes Mellitus Depending on Changes in Glycemia Level in the Context of Lifestyle—An Overview of the Latest Scientific Discoveries. CIMBiology. 2023;45(3):1961-81. https://doi.org/10.3390/cimb45030126.
6. AlKenany Q, Rasheed MK, AlKazraj KA. The Predictive Role of Osteopontin Level in Patients with Type 2 Diabetes Mellitus without Fatty Liver Disease. JFacMedBaghdad. 2024;66(1):93-8. https://doi.org/10.32007/jfacmedbagdad.6612182
7. Al-Yassin HD. Correlation of Serum levels of Chromium, Copper, and Manganese with the Glucose levels in Type 2 Diabetes Mellitus in Iraq. JFacMedBaghdad. 2023;65(4). https://doi.org/10.32007/jfacmedbagdad.2126
8. Taha BE, Majeed MJ. Estimation of Insulin Resistance in Obese Adults in Baghdad. JFacMed Baghdad. 2023;65(4). https://doi.org/10.32007/jfacmedbagdad.2118.
9. Liu Z, Shao M, Ren J, Qiu Y, Li S, Cao W. Association between increased lipid profiles and risk of diabetic retinopathy in a population-based case-control study. JIR. 2022;15:3433-46. https://doi.org/10.2147/JIR.S361613.
10. Julve J, Rossell J, Correig E, et al. Predictive value of the advanced lipoprotein profile and glycated proteins on diabetic retinopathy. Nutrients. 2022;14(19):3932. https://doi.org/10.3390/nu14193932.
11. Hirano T, Hayashi T, Sugita H, et al. Prospective randomized comparative study of the effect of pemafibrate add‐on or double statin dose on small dense low‐density lipoprotein‐cholesterol in patients with type 2 diabetes and hypertriglyceridemia on statin therapy. J Diabetes Investig. 2023;14(12):1401-11. https://doi.org/10.1111/jdi.14076
12. Sun C, Chen Q, Zhang X, et al. Peripheral Neuropathy Is Associated With High Serum Levels of Small Dense Low-density Lipoprotein-cholesterol in Patients With Type 2 Diabetes Mellitus. 2021.
13. Otrante A, Bounafaa A, Berrougui H, Essamadi A-K, Nguyen M, Fülöp T, et al. Small Dense LDL Level and LDL/HDL Distribution in Acute Coronary Syndrome Patients. Biomedicines. 2023;11(4):1198. https://doi.org/10.3390/biomedicines11041198
14. Płaczkowska S, Sołkiewicz K, Bednarz-Misa I, Kratz EM. Atherogenic plasma index or non-high-density lipoproteins as markers best reflecting age-related high concentrations of small dense low-density lipoproteins. IJMS. 2022;23(9):5089. https://doi.org/10.3390/ijms23095089
15. Nakayama A, Morita H, Sato T, et al. Small dense low-density lipoprotein cholesterol is a potential marker for predicting laser treatment for retinopathy in diabetic patients. JAT. 2022;29(5):678-91. https://doi.org/10.5551/jat.62889
16. Atchison E, Barkmeier A. The role of systemic risk factors in diabetic retinopathy. Current Ophthalmology Reports. 2016;4:84-9. https://doi.org/10.1007/s40135-016-0098-8.
17. Soedarman S, Kurnia KH, Prasetya ADB, Sasongko MB. Cholesterols, apolipoproteins, and their associations with the presence and severity of diabetic retinopathy: a systematic review. Vision. 2022;6(4):77. https://doi.org/10.3390/vision6040077
18.Bryl A, Mrugacz M, Falkowski M, Zorena K. The Effect of Hyperlipidemia on the Course of Diabetic Retinopathy—Literature Review. JCM. 2022;11(10):2761. https://doi.org/10.3390/jcm11102761
19. Hukportie DN, Li FR, Zhou R, et al. Lipid variability and risk of microvascular complications in Action to Control Cardiovascular Risk in Diabetes (ACCORD) trial: A post hoc analysis. J Diabetes. 2022;14(6):365-76. https://doi.org/10.1111/1753-0407.13273
20. Li Z, Yuan Y, Qi Q, Wang Q, Feng L. Relationship between dyslipidemia and diabetic retinopathy in patients with type 2 diabetes mellitus: a systematic review and meta-analysis. Syst Rev. 2023; 12:148. https://doi.org/10.1186/s13643-023-02321-2
21. Romero-Aroca P, Verges R, Pascual-Fontanilles J, et al. Effect of Lipids on Diabetic Retinopathy in a Large Cohort of Diabetic Patients after 10 Years of Follow-Up. JCM. 2023;12(20):6674. https://doi.org/10.3390/jcm12206674
22. Chou Y, Ma J, Su X, Zhong Y. Emerging insights into the relationship between hyperlipidemia and the risk of diabetic retinopathy. Lipids Health Dis. 2020; 19:241. https://doi.org/10.1186/s12944-020-01415-3
التنزيلات
منشور
إصدار
القسم
الفئات
الرخصة
الحقوق الفكرية (c) 2025 Nawar M. Jawad, Halla G. Mahmood, Abeer A. Mohammed

هذا العمل مرخص بموجب Creative Commons Attribution 4.0 International License.











 Creative Commons Attribution 4.0 International license..
Creative Commons Attribution 4.0 International license..


